Základní metody genetického inženýrství
Genetické inženýrství je fenomén, který má své počátky již hluboko v minulém století. Manipulace s nukleovými kyselinami jsou dnes již na denním pořádku. Na analýze nukleových kyselin je založena celá řada diagnostických metod. Manipulace a analýza nukleových kyselin je podstatou celé řady genetických výzkumných projektů.
Pod pojmem genetické inženýrství si dnes představuje hlavně manipulaci s nukleovými kyselinami a jejich případnou modifikaci. Zatímco pro klasickou dědičnost organizmů je typický vertikální přenos DNA ("shora - dolů"; myšleno z generace na generaci), metody genetického inženýrství umožňují i tzv. horizontální přenos (přenos mezi jednou generací). Ovšem nejen to, neboť přenášenou DNA umíme již i upravovat a různě modifikovat, či dokonce syntetizovat uměle.
Restrikční endonukleázy
Restrikční endonukleázy jsou enzymy, které jsou schopny štěpit dvoušroubovici DNA v určitých specifických sekvencích. Byly objeveny v bakteriích, kde slouží jako ochrana před cizorodou DNA (především DNA bakteriofágů). Bakteriální DNA je před jejich účinkem zpravidla chráněna methylací DNA v místech rozpoznávaných sekvencí.
Místa rozpoznávané restrikčními endonukleázami jsou většinou palindromatické sekvence (palindromatické sekvence mají stejné pořadí nukleotidů čtené ve směru od 5' konce na obou dvou vláknech DNA).
Příklad palindromatické sekvence u enzymu EcoRI (mezi červeně označenými nukleotidy dochází ke štěpení):
5' GAATTC 3'
3' CTTAAG 5'
Jak vidíme v příkladu u enzymu Eco RI (zkratka Eco vychází z názvu bakterie, ze které je příslušná endonukleáza izolována; v tomto případě Escherichia coli), může docházet ke štěpení mezi nukleotidy, které neleží naproti sobě; konce rozštěpené dvoušroubovice jsou pak nestejně dlouhé. Takovéto konce označujeme jako lepivé (kohezní).
Pokud restrikční endonukleasa štěpí mezi protilehlými nukleotidy, potom jsou konce dvoušroubovice zarovnané - tupé konce.
Restrikční endonukleasy mají velký význam, neboť umožňují specificky vyštěpovat různé DNA sekvence. Existuje totiž relativně velké množství takovýchto endonukleas (izolovaných z různých bakterií), tudíž máme i velké množství možností na vyštěpování žádaných úseků DNA (existují tzv. restrikční mapy, kde jsou v genomových sekvencích naznačena místa, kde lze sekvenci určitou endonukleasou štěpit). Prvním významem je tudíž vyštěpování požadovaných (k dalšímu použití) DNA sekvencí z delšího úseku DNA.
V diagnostice dědičných chorob se potom využívá takzvané restrikční analýzy, založené na polymorfizmu délky restrikčních fragmentů (RFLP - Restriction Fragment Length Polymorphism). Jedná se o to, že různí lidé mají různou DNA sekvenci (zvláště v nekódujících oblastech DNA, kde se různé varianty nijak fenotypově neprojevují), tudíž mají i různě umístěná místa, kde mohou restrikční endonukleasy štěpit. Zároveň se využívá skutečnosti, že při různých genetických mutacích mohou být určité sekvence DNA deletovány, nebo naopak přidány.
Výsledkem je již zmíněný (a z diagnostického hlediska užitečný) polymorfizmus délky restrikčních fragmentů. Po štěpení určité sekvence DNA (ve které se nachází i sledovaný gen) restrikční endonukleasou získáme nestejně dlouhé fragmenty DNA, které můžeme elektroforeticky (viz níže) rozdělit a následně vyhodnotit.
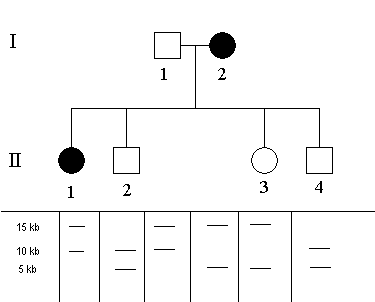
Na uvedeném hypotetickém příkladě si ukážeme základy restrikční analýzy. Matka (I/2) trpí hypotetickou autozomálně dominantní chorobou. V rodině je jedna další postižená osoba a to dcera (II/1). Byla provedena RFLP analýza (štěpení restrikční endonukleasou a následná elektroforéza fragmentů) a pod rodokmenem jsou prezentovány jejich výsledky. Pod každým jedincem jsou vidět dva fragmenty, jak byly rozděleny během elektroforézy (viz níže). Různá délka odpovídá různě dlouhému fragmentu po štěpení restrikční endonukleasou; 2 délkové varianty odpovídají dvěma kopiím DNA, které má každý jedinec.
Principem této analýzy je vysledovat, který rodič předal jaký fragment (víceméně odpovídá segregaci chromosomů při tvorbě gamet).
Otec má fragmenty o délce 10 kb (kilobází) a 15 kb. Matka má fragmenty o délce 5 kb a 15 kb.
Nyní vysledujeme, kdo z potomků získal jaký fragment:
- Dcera (II/1) má fragmenty o délce 15 kb a 10 kb. Jeden z nich musí pocházet od otce a druhý od matky. Zatímco fragment 15 kb může pocházet od obou rodičů; fragment 10 kb může pocházet pouze od otce (matka jej nemá). Fragment 15 kb je tedy od matky.
- Syn (II/2) musí mít fragment 5 kb od matky (otec jej nemá) a tím pádem tedy fragment 10 kb je od otce (rovněž jediná možnost).
- Dcera (II/3) musí mít rovněž fragment 5 kb od matky; fragment 15 kb pochází od otce.
- Syn (II/4) má stejnou kombinaci fragmentů jako jeho bratr (II/2); fragment 10 kb od otce a fragment 5 kb od matky.
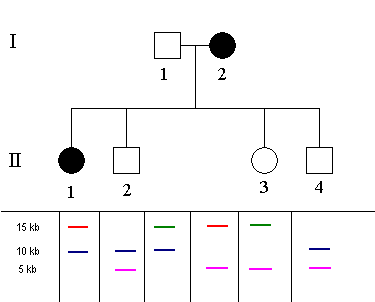
Pokud si původ fragmentů nějakým způsobem označíme (v tomto případě barevně), můžeme již vysledovat, který fragment je ve vazbě s mutovanou alelou.
To je účelem restrikční analýzy. Pokud můžeme tento fragment určit, potom označujeme analýzu jako informativní. Pokud však nedokážeme fragment ve vazbě s mutovanou alelou vystopovat, potom označujeme analýzu jako neinformativní.
Obě postižené osoby mají fragment délky 15 kb od matky (označen červeně). Právě tento fragment je tedy ve vazbě s mutovanou alelou (při zanedbání možnosti rekombinace crossing-overem).
Další enzymy
Při úpravách rekombinantní DNA se používají i další enzymy. Velký význam má zejména DNA ligasa, která umožňuje spojování různých DNA fragmentů (například různé fragmenty, vzniklé štěpením restrikčními endonukleázami).
Elektroforéza
Elektroforéza je dělící metoda, založená na rozdílné pohyblivosti dělených struktur v elektrickém poli. Dělení DNA (i RNA) fragmentů je založeno na skutečnosti, že zbytky fosforečné kyseliny (jakožto součásti nukleotidů) mají záporný náboj. Nukleové kyseliny (NK) se tudíž v elektrickém poli chovají jako polyaniotnty (pohybují se ke kladnému pólu).
Elektroforetické dělení NK probíhá nejčastěji na agarosovém nebo polyakrylamidovém gelu. Menší částice (kratší úseky NK) se pohybují rychleji a urazí tedy delší vzdálenost. Stejně dlouhé fragmenty urazí tudíž stejně dlouhou vzdálenost. Využití nachází elektroforéza NK (nejen) při restrikční analýze (viz výše).
Southern blotting
Southern blotting (přenos) je metoda, která umožňuje lépe vizualizovat výsledky elektroforézy nukleových kyselin. Kroky jsou následující:
- Necháme proběhnout elektroforézu DNA fragmentů.
- Pomocí alkalické kapaliny (pufru) necháme vzlínat molekuly DNA z gelu na fólii (nejčastěji z nitrocelulózy), kde se molekuly DNA fixují (teplem). V alkalickém prostředí zároveň DNA denaturuje (vlákna se oddělí, aby mohlo v příštím kroku dojít k hybridizaci se sondou).
- Na fólii necháme působit další pufr s nukleotidovými sondami (v nadbytku), které hybridizují s komplementárními sekvencemi na fólii zachycených fragmentů DNA. Sondy jsou značeny radioaktivním izotopem nebo (nyní častěji) fluorescenčním barvivem.
- Nyní již můžeme vizualizovat sondou značené fragmenty (podle použitého značení sondy buď autoradiografií nebo detekcí fluorescence). Získáme výsledek podobný tomu, jaký byl ukázán pod rodokmenem v příkladu s analýzou RFLP (viz výše).
Jako Northern blotting označujeme vizualizaci elektroforézy RNA, která probíhá obdobně jako v případě Southern blottingu.
Western blotting se používá při elektroforéze bílkovin, pro jejichž značení se využívají imunochemické metody.
Genové knihovny
V počátcích genového inženýrství bylo velmi obtížné namnožit (naklonovat) požadovaný úsek molekuly DNA. Za tímto účelem byla požadovaná DNA sekvence integrována do plazmidu (mimojaderná cirkulární DNA molekula u bakterií) a ten byl vnesen do bakteriální buňky. S namnožením bakterie došlo i k namnožení DNA fragmentu.
Tento postup měl své nevýhody (především pomalou rychlost klonování a obtíže se zpětným izolováním namnoženého DNA fragmentu), proto je v současnosti již zcela nahrazován metodou PCR (viz dále). Princip této metody však byl a stále je užíván při tvorbě genových knihoven.
Knihovny většinou obsahují velké množství informací. Genové knihovny obsahují velké množství genetických informací (genů). Představte si, že celý lidský genom rozštěpíte endonukleázami na obrovský počet fragmentů. Každý fragment potom budete klonovat v jedné bakteriální populaci (v plazmidech). Nakonec získáte velké množství bakteriálních populací a v každé z nich budete mít namnožený určitý fragment lidského genomu - bude se jednat o genomovou knihovnu.
Použitím reverzní transkriptasy (RNA - dependentní - DNA polymerasy) můžeme přepsat genetickou informaci z RNA do DNA. Běžně toto aplikují retroviry během svého životního cyklu, ale lze toho využít při syntéze cDNA. Písmenko c znamená "complementary" a vyjadřuje skutečnost, že vzniklá DNA je komplementární k RNA (nejčastěji mRNA). Pokud izolujeme všechny mRNA z určitého typu buňky (například z jaterní buňky - hepatocytu) a podle nich vytvoříme reverzní transkriptasou příslušné cDNA, které opět klonujeme v bakteriích, získáme cDNA knihovnu hepatocytu. Tímto způsobem zjišťujeme, jaké geny jsou v konkrétní buňce přepisovány. Protože je cDNA kopií mRNA, je tvořena sekvencí, která neobsahuje introny!
Mimo bakteriální plazmidy se pro uchovávání DNA dále používají například bakteriofágy nebo umělé chromosomy.
Využití bakterií pro syntézu proteinů
Bakterie lze rovněž využít pro produkci určitého proteinu. Jako první byl metodami rekombinantní DNA připraven lidský insulin. Nejprve musíme získat cDNA požadovaného proteinu (bakterie nemá schopnost odstraňovat z genu introny; vnesením celého lidského genu pro insulin bychom tak požadovaný produkt nezískali), kterou vložíme do bakteriálního plazmidu. Pro vysokou efektivitu produkce je vhodné před insulinový gen zařadit vysoce aktivní promotorovou sekvenci, která zajistí mohutnou transkripci vneseného genu.
Takto modifikované bakterie potom produkují vysoce kvalitní lidský insulin. Podobným způsobem lze však připravovat pouze jednoduché proteinové produkty, jejichž struktura je dána samotnou sekvencí aminokyselin. Složité produkty z několika podjednotek a jinak modifikované bakterie syntetizovat nemohou.
Na vnesení genetické informace do buňky je založena i genová terapie.
PCR
PCR - Polymerase Chain Reaction (Polymerasová řetězová reakce) je metoda, díky které lze mnohonásobně naklonovat požadovaný úsek DNA, navíc v krátké době.
Pro provedení reakce potřebujeme:
- Vlákno DNA s úsekem, který chceme namnožit (existuje zde omezení délkou)
- Dva typy oligonukleotidů, které ohraničují z obou stran požadovaný úsek DNA a budou sloužit jako primery pro polymeraci
- Termostabilní DNA polymerasu
- Deoxynukleotid-trifosfáty pro stavbu budoucích řetězců DNA
- Kapalinu (pufr), ve které bude reakce probíhat
- Nástrojové, přístrojové a softwarové vybavení (moderní přístroje se nazývají cyklery)
Postup je zhruba následující:
- Do zkumavky jsou přidány všechny potřebné součásti reakce (DNA vzor, primery, pufr, polymeráza)
- Během prvního cyklu je v cykleru nejprve zvýšena teplota, čímž dojde k denaturaci vzorové DNA (dojde k narušení vodíkových můstků a vlákna se od sebe oddělí).
- Po snížení teploty mohou komplementární úseky opět renaturovat. Jelikož primery jsou ve velkém nadbytku, je vysoce pravděpodobné, že dojde k hybridizaci primerů na komplementárních místech, ohraničující úsek určený k namnožení.
- Od nasednuvších primerů syntetizuje Dna-polymeráza zbytek sekvence (je důležité, aby šlo o termostabilní polymerasu, jinak by při zvýšené teplotě v první fázi cyklu došlo k její denaturaci a v této fázi by se po každém cyklu musela polymerasa opět přidat; využívají se polymerasy druhů bakterií, které žijí za vysokých teplot - např. Thermus aquaticus).
Po čtvrté fázi následuje opět denaturace zvýšenou teplotou. Již po několika cyklech získáme veliké množství požadovaného úseku DNA. Po 30 cyklech dojde k namnožení asi v řádu 109.
PCR nachází využití mimo jiné při detekci viru HIV nebo při DNA diagnostice ve forenzní medicíně (či obecně při určování totožnosti).
Obrázek - Postup PCR reakce: (1) denaturace (2) nasednutí primerů (3) prodlužování vlákna DNA (4) konec prvního cyklu PCR

Transgenní organizmy
Organizmy, do kterých jsou vneseny nové nebo pozměněné geny, označujeme jako transgenní. Na různých modelových organizmech jsou například používány metody cílené mutageneze, kdy se pozoruje fenotypový projev mutace určitého genu (někdy je nejlepším způsobem pro pochopení funkce genu jeho cílené vyřazení z funkce a následné pozorování následků).
Jako "knock-out" genu se označuje cílené vyřazení genu z funkce (například vytvořením STOP kodonu). Pokud je funkce genu jenom určitým způsobem snížena - jde o "knock-down" genu.
Na obdobném principu je založena i genová terapie, ovšem zde nevnášíme mutovanou genetickou informaci, ale naopak se snažíme minimalizovat následky vrozených mutací.





