Onkogenetika
Nádorová onemocnění obecně
Nádorová onemocnění jsou stále velikým problémem moderní medicíny. I v dnešní době jsou jednou z nejčastějších příčin úmrtí. Stále diskutovanou otázkou pak je, nakolik jsou nádorová onemocnění způsobována negativními vnějšími vlivy během života a nakolik jsou podmíněny dědičně.
Vznik nádorového onemocnění je složitý, mnohastupňový proces. Tedy aby buňka prošla procesem maligní transformace, je nutná účast mnoha faktorů. Nádorová buňka se oproti normální liší především svou nekontrolovanou schopností dělit se. Buněčný cyklus je velmi přesně a citlivě regulovaný děj. Na regulaci se podílí velké množství genů a jejich produktů. Narušení určitých genů tedy může "odblokovat" kontrolní mechanizmy buněčného cyklu a způsobit nekontrolované dělení oné buňky.
V nádorových buňkách tudíž nacházíme mutace v určitých genech (typy zúčastněných genů - viz níže). Tyto mutace mohou být vrozené (familiární výskyt určitých nádorů) nebo jsou způsobeny až během životy jedince různými mutageny - kancerogeny.
Kancerogeny (karcinogeny) jsou mutagenní faktory, které svým účinkem způsobují (nebo napomáhají vzniku) nádorového onemocnění. Kancerogeny dělíme (stejně jako obecně mutageny) na:
- Fyzikální (např. různé formy záření)
- Chemické (různé chemikálie, např. aromatické uhlovodíky)
- Biologické (především různé onkogenní viry)
Protoonkogeny a onkogeny
V buněčném genomu se vyskytují geny, jejichž narušení (mutací) má přímý vliv na proces maligní transformace. Jedná se o geny, které mají za normálních podmínek určitou strukturní funkci (příklady - viz níže). V tomto stádiu se nazývají protoonkogeny; plní svoji obvyklou funkci a nemají žádné negativní vlivy na buňku. Je však třeba si uvědomit, že i normální vliv protoonkogenů je většinou promitotický (tedy podporující dělení buňky); narozdíl od tumor - supresorových genů (viz níže), které svým normálním účinkem naopak dělení buňky brání.
Onkogeny jsou tytéž strukturní geny, ovšem již určitým způsobem mutované. Jak již název napovídá, je jejich vliv na buňku čistě negativní ("rakovinotvorný"). Ačkoliv se v genomu buňky každý gen vyskytuje ve dvou kopiích, u protoonkogenů stačí mutace v jedné kopii genu k odstartování maligní transformace (můžeme se setkat s označením - dominantní onkogeny).
Jak jsme již řekli, protoonkogeny fungují jako normální strukturní geny buňky. Kódují především:
- Různé růstové faktory a jiné látky, ovlivňující růst buněk
- Receptory pro růstové faktory
- Faktory zúčastněné při přenosu signálu v buňce (transdukční mechanismy)
- Faktory zúčastněné při regulaci genové exprese (transkripční faktory)
Připomeňme si, že základní osa regulace buněčného růstu a dělení je tato:
Syntéza růstového faktoru → růstový faktor → příslušný receptor → přenos biosignálu z receptoru → výkonné mechanismy, často interagující s jadernou DNA → výsledné ovlivnění buněčného cyklu
Jak vidíme, mutace protoonkogenu tak může tento proces narušit v kterékoli jeho fázi. Nicméně v každém případě je modifikován výstup tohoto procesu a tím je kontrola buněčného cyklu.
Mezi protoonkogeny patří například: SRC, FOS nebo JUN
Nejčastěji u protoonkogenů dochází k těmto typům mutací:
- Bodovým mutacím, které naruší původní sekvenci nukleotidů a způsobí zařazení odlišné aminokyseliny nebo předčasné ukončení translace (vznik STOP kodonu)
- Chromosomovým přestavbám, kdy dochází k narušení sekvence genu, nebo k přemístění genu k vysoce aktivní promotorové sekvenci (gen bude přepisován mnohem častěji než za normálních podmínek)
- Znásobením (amplifikací) sekvence genu v genomu buňky
Mutace v buněčném genomu vedoucí k maligní tranformaci mohou být způsobeny také onkogenními viry (nejčastěji jde o retroviry - viz onkogenní viry).
Pomalu transformující viry naruší inzercí své sekvence do genomu buňky sekvenci některého z protoonkogenů (inzerce vysoce aktivního genového promotoru způsobí zvýšení transkripce). Maligní transformace buňky po infekci těmito viry je pomalejší než u rychle transformujících virů - viz níže.
Rychle transformující viry obsahují přímo ve své virové genetické informaci některý z onkogenů (dostal se do kapsidy při chybném vyštěpení vložené virové sekvence při resyntéze virových částic v průběhu virové infekce buňky). Inzercí této genetické informace do dalších infikovaných buněk dojde k amplifikaci sekvence určitého onkogenu v buňce a k rychlejšímu nástupu maligní transformace.
Některé viry nemodifikují přímo genom buňky, ale mají onkogenní účinek díky působení virových proteinů na regulátory buněčného cyklu a další faktory.
Tumor - supresorové geny
Jak již název napovídá, tumor - supresorové geny potlačují vznik nádorového onemocnění. Jejich prvotní funkcí je tedy regulace buněčného cyklu, čímž zabraňují, aby se buňka začala nekontrolovaně dělit. Na rozdíl od onkogenů, musí být obě kopie tumor - supresorového genu v buňce vyřazeny z funkce (proto se můžeme také setkat s označením - recesivní onkogeny), aby mohlo dojít k procesu maligní tranformace.
Tyto geny hrají důležitou roli při dědičnosti nádorových onemocnění. V normální zdravé buňce je zapotřebí, aby mutace postihla postupně obě kopie konkrétního tumor - supresorového genu. Pokud však jedinec po některém z rodičů zdědí již jednu kopii tumor - supresorového genu mutovanou (lze ho tedy považovat za heterozygota), potom stačí aby mutace postihla jen jednu kopii genu - tu zdravou (V této souvislosti se hovoří o tzv. Knudsonově teorii dvojího zásahu, kdy prvním zásahem je myšleno "zdědění" první mutované kopie po některém z rodičů a jako zásah druhý je označována mutace druhé kopie genu v průběhu života).
Lidé s těmito dědičnými předpoklady mají znatelně zvýšenou šanci, že u nich dojde k rozvoji určitého nádorového onemocnění.
Nejznámější tumor - supresorové geny jsou TP53 a RB1.
TP53 gen a jeho produkt - protein p53 zastávají velmi významnou úlohu při regulaci buněčného cyklu. Především zajišťují, aby se buňka nezačala dělit, pokud je její jaderná DNA nějakým způsobem poškozena. Pokud není genetická informace buňky v pořádku - dochází činností p53 především ke dvěma typům odpovědí:
Prvním typem odpovědi je pozastavení buněčného dělení a pokus o opravení poškozené DNA (zde se uplatňuje především protein p21).
Druhým typem odpovědi je potom navození apoptózy, pokud se ukáže, že poškození DNA je příliš velké a neopravitelné (zde se uplatňují induktory apoptózy např bax).
Pro velký význam pro zachování stability genetické informace se genu TP53 přezdívá "strážce genomu".
Obrázek 1 - Funkce proteinu p53

RB1 gen je důležitý pro udržení buňky v klidovém stavu (v interfázi). Zabraňuje nechtěnému spuštění procesu dělení buňky. Jeho produkt - protein p105 RB (či jednoduše RB protein) - váže v normálním stavu faktor potřebný k přechodu do S fáze buněčného cyklu (E2S transkripční faktor). Při fyziologické aktivaci buňky k dělení je potom inhibiční aktivita RB proteinu inaktivována fosforylací. Fosforylovaný RB protein je neaktivní.
RB1 gen je rovněž známý díky své úloze při vzniku retinoblastomu - viz níže.
Další geny
Na vzniku nádorového onemocnění se můžou dále uplatnit další geny. Jsou to především geny udržující stabilitu genomu (s reparační funkcí, někdy též nazývané "mutátorové geny") a geny regulující apoptózu.
Při ztrátě funkce mutátorových genů (obou kopií) dochází k častějšímu poškození DNA a riziko vzniku nádorového onemocnění tak stoupá.
Poškozená regulace apoptózy se může negativně projevovat jak nepřiměřeně častým spouštěním apoptózy, tak i sníženou schopností (či neschopností) buněk apoptotický proces spustit (právě tato skutečnost zvyšuje riziko maligní transformace buňky, které nezahyne při poškození DNA apoptózou).
Vznik a růst nádoru
Předchozí řádky se převážně věnovaly genetickým procesům, které způsobují, že se normální buňka přemění v buňku nádorovou. Již výše bylo uvedeno, že vznik nádorového onemocnění je mnohastupňový proces. Ve skutečnosti je zapotřebí třeba i 5 či 6 zásahů do normálního stavu buňky, aby se tato změnila na buňku rakovinnou. Tyto zásahy pak zahrnují výše popsané mutace protoonkogenů i tumor - supresorových genů, dále genů mutátorových, regulujících apoptózu či určitým způsobem regulujících buněčný cyklus. Jen vzácně způsobí jediná mutace maligní tranformaci sama o sobě.
Nádorové buňky se od normálních buněk liší zejména:
- Schopností neomezeného růstu (ztráta kontaktní inhibice pozorovatelná in vitro, schopnost invazivního růstu in vivo)
- Scopností růstu i bez stimulace růstovými faktory
- Nesmrtelností (nádorové buňky se nedělí jen po omezený počet generací jako normální buňky)
- Tvorbou určitých membránových antigenů, specifických pro nádorové buňky (TAA - Tumor asociated antigen). Naopak tvorba normálních antigenů může být potlačena.
- Pro nádorové buňky je typická vysoká chromosomální nestabilita. Nádorové buňky mají často změněný počet chromosomů a vykazují i časté chromosomální přestavby.
V živém organismu je růst nádoru zpočátku prudký, později se zpomaluje. Největším nebezpečím u zhoubných nádorů je jejich schopnost metastázovat. Metastázování je schopnost nádorových buněk cestovat lymfatickým nebo krevním řečištěm z místa prvotního nádorového ložiska, uchytit se a na tomto novém místě vytvořit sekundární nádorové ložisko. Dochází tak k šíření nádorových buněk po celém těle.
Vybraná onemocnění
Retinoblastom - Jedná se o maligní nádor sítnice. Jedná se o závažné onemocnění, které neléčené končí až ztrátou zraku nebo dokonce smrtí. Existují sporadicky se vyskytující případy retinoblastomu (většinou unilaterální forma - postiženo je jen jedno oko), stejně jako rodinný výskyt, kdy retinoblastom vykazuje dědičnost (zde jde většinou o oboustrannou - bilaterální formu).
Familiární forma retinoblastomu je onemocnění způsobené mutací RB1 genu. Pokud jedinec dostane od rodiče již jednu kopii RB1 genu mutovanou, potom má neúměrně vyšší šanci, že se u něj onemocnění rozvine - proto je bilaterální forma retinoblastomu tak častá u postižených s dědičnými předpoklady. Jde tedy o recesivní mechanizmus vzniku onemocnění - příznačný pro dědičná nádorová onemocnění, způsobená mutací tumor - supresorového genu. V rodokmenu se potom toto onemocnění projevuje jako autozomálně dominantní s neúplnou penetrancí (jde tedy o to, že již jedna mutovaná alela z páru přináší tak vysoké riziko vzniku nádoru, že v rodokmenu potom vykazuje dominantní typ dědičnosti; nádor se však nemusí rozvinout vždy, protože je zde stále nutnost vyřazení i druhé alely).
Obrázek 2 - Dítě s retinoblastomem
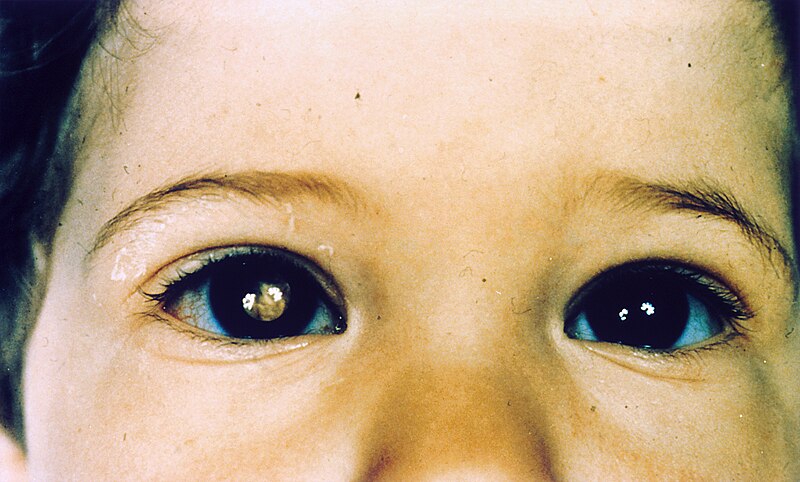
Li-Fraumeni syndrom - Li-Fraumeniův syndrom je dědičné onemocnění, způsobené mutací TP53 genu. Fenotypově je onemocnění velice variabilní - projevy zahrnují nádory prsů, mozku, jiných měkkých tkání nebo třeba i leukémii. Na tomto onemocnění je dobře patrné, jak důležitou a rozsáhlou funkci má TP53 jako tumor - supresorový gen.
Neurofibromatóza - Existují dva typy neurofibromatózy. Typ 1 (syndrom von Recklinghausen) je způsoben mutací NF1 genu. Projevuje se hlavně vznikem benigních nádorů (tzv. neurofibromů) a bílými až kávovými skvrnami na kůži. Zvýšené je riziko vzniku různých maligních nádorů.
Typ 2 je způsoben mutací NF2 genu. Projevuje se například nádory nervové tkáně (hluchota, mentální postižení, poruchy rovnováhy).
Hereditární karcinom prsu - Většina karcinomů prsu se vyskytuje sporadicky (tedy bez přímé souvislosti s dědičností). Existují však i formy s významnou dědičnou komponentou. V této souvislosti potom nacházíme nejčastěji mutace genů BRCA1 a BRCA2.
Familiární adenomatózní polypóza - Jde o jednu z nejčastějších forem rakoviny tlustého střeva. Vznik tohoto onemocnění je dlouhodobý a zahrnuje několik různých kroků, než se onemocnění finálně rozvine. Typickým znakem je mutace APC genu, spojená s mutací DCC genu. U postižených jedinců se v tlustém střevě vytváří velké množství útvarů - polypů, které jsou z počátku benigní, ale časem začnou být i maligní a onemocnění se stává nebezpečnějším.
Hereditární nepolypózní karcinom tlustého střeva - Toto onemocnění je vzácnější formou karcinomu tlustého střeva, která se neprojevuje vznikem polypů. Příčinou je mutace v některém z mutátorových genů (například MLH1, MLH3, MSH2, MSH6, PMS1, nebo PMS2). Pokud je postiženo pouze tlusté střevo - označuje se onemocnění jako Lynchův syndrom I. Pokud jsou postiženy i další orgány (žaludek, žlučník, pankreas), používá se označení Lynchův syndrom II.
Burkittův lymfom - Jde o monoklonální lymfom z B-lymfocytů. Příčinou je translokace onkogenu c-myc z 8. chromosomu na jiný chromosom, kde se vloží do genu, který kóduje část molekuly imunoglubulinu (tyto geny jsou na chromosomech 2, 14 a 22; translokace tedy probíhá mezi 8. a některým z těchto chromosomů.); rozvoj malignity souvisí s velkou transkripční aktivitou těchto imunoglobulinových genů. Zdá se, že vznik Burkittova lymfomu může zapříčinit i infekce virem Epsteina a Barrové (EBV).
Chronická myeloidní leukemie - Toto onemocnění je charakteristické reciprokou translokací mezi dlouhými raménky 9. a 22. chromosomu - t(9;22) - tato přestavba se nazývá Filadelfský chromosom. Touto přestavbou vzniká hybridní gen, jehož produkt je zcela nefyziologický a prokazatelně způsobuje maligní transformaci.
Syndromy chromosomální nestability - Jedná se o autosomálně recesivně dědičné choroby, způsobené mutacemi v DNA reparačních genech. Tato neschopnost reparace způsobuje nejen přímý projev choroby, ale zároveň u všech těchto onemocnění nacházíme zvýšenou pravděpodobnost vzniku maligního nádoru.
Patří sem například:
- Ataxia teleangiectasia
- Bloomův syndrom
- Fanconiho anémie
- Xeroderma pigmentosum
Rozsáhlejší informace naleznete v článku hereditární nádorové syndromy.
Externí odkazy a obrázky
- Onkogenetika - skripta pro VŠCHT (PDF, česky)
- Vznik nádorového onemocnění z hlediska molekulové patobiochemie (PPT, česky)





